Sebelum akan dibahas mengenai atom, berikut ini ada video, "Pernahkah kalian melihat atom?"
Pada 2500 tahun yang lalu, para ilmuan Yunani Kuno menyatakan bahwa materi terdiri dari bagian-bagian yang sangat kecil, disebut atom. Kata atom berasal dari kata atomos yang berarti tidak dapat dibagi-bagi lagi. Pendapat ini dikembangkan oleh Democritus dan dapat bertahan lama sekali, walaupun para ilmuan pada zaman itu belum bisa menjelaskan peristiwa-peristiwa perubahan zat yang terjadi di alam.
Pada 2500 tahun yang lalu, para ilmuan Yunani Kuno menyatakan bahwa materi terdiri dari bagian-bagian yang sangat kecil, disebut atom. Kata atom berasal dari kata atomos yang berarti tidak dapat dibagi-bagi lagi. Pendapat ini dikembangkan oleh Democritus dan dapat bertahan lama sekali, walaupun para ilmuan pada zaman itu belum bisa menjelaskan peristiwa-peristiwa perubahan zat yang terjadi di alam.
Istilah atom pertama kali diajukan
oleh Anaxagoras. Democritus hanya mengungkapkan bahwa atom sangat kecil
sehingga tidak dapat dibagi-bagi lagi.
Selanjutnya berkembanglah teori
model atom oleh beberapa ahli, yaitu:
a. J.
Dalton
Menurut Dalton, atom berupa
butiran-butiran yang sangat kecil yang digambarkan dalam bentuk bola kecil.
Diameter bola atom untuk setiap unsure berbeda-beda. Bola atom paling kecil
adalah atom hydrogen.
b. J.J
Thomson
Thomson memperbaiki kelemahan atom Dalton. Hasil penelitiannya menyatakan bahwa ada partikel bermuatan negative dalam atom yang disebut electron. Thomson mengusulkan model atom, seperti roti kismis atau kue onde-onde. Menurutnya, atom berbentuk bola pejal yang permukaannya dikelilingi electron dan partikel lain yang bermuatan positif sehingga atom bersifat netral.
Thomson memperbaiki kelemahan atom Dalton. Hasil penelitiannya menyatakan bahwa ada partikel bermuatan negative dalam atom yang disebut electron. Thomson mengusulkan model atom, seperti roti kismis atau kue onde-onde. Menurutnya, atom berbentuk bola pejal yang permukaannya dikelilingi electron dan partikel lain yang bermuatan positif sehingga atom bersifat netral.
c. E.
Rutherford
d. Niels
Bohr

Pendapat Bohr pada dasarnnya menyempurnakan teori atom Rutherford. Bohr menjelaskan bahwa electron mengelilingi inti atom pada lintasan tertentu dengan energi tertentu sehingga ketika ada electron yang melepaskan energy, electron akan berpindah ke lintasan/ kulit electron yang lebih dalam. Sebaliknya, jika ada electron yang menerima energy, electron tersebut akan berpindah ke lintasan/ kulit yang lebih luar.
Pertikel
Dasar Penyusun Atom
Partikel
penyusun atom diantaranya yaitu:
1. Electron, yaitu partikel bermuatan
negative. Biasa ditulis dengan symbol e dengan
muatan -1 sehingga ditulis e-.
2. Inti atom, yang terdiri dari proton
dan neutron. Proton yaitu partikel bermuatan positif. Biasa ditulis dengan
symbol p dengan harga +1. Sedangkan neutron
adalah partikel yang tidak bermuatan listrik.
Orbit electron
tidak terdapat pada satu bidang datar, tetapi berada dalam ruang. Banyaknya
electron pada tiap kulit mempunyai jumlah maksimum, artinya jumlah electron
pada tiap kulit tidak pernah melebihi jumlah tertentu. Jumlah maksimum electron
pada suatu kulit dinyatakan dengan rumus 2n2, n adalah nomor kulit.
Kulit pertama
merupaka kulit yang paling dekat dengan inti atom disebut kulit K, jumlah
maksimum elektronnya= 2. 12 = 2 elektron. Kulit kedua disebut kulit
L, maksimum elektronnya = 2. 22 = 8. Kulit ketiga yaitu kulit M,
maksimum elektronnya = 2. 32 = 18. Kulit keempat N, maksimum
elektronnya = 2. 42 = 32.
Jumlah maksimum
electron pada kulit-kulit berikutnya (O,P,Q, dan R) adalah sama dengan
angka-angka di atas dan maksimum 32 elektron. Jumlah electron pada kulit paling
luar tidak pernah lebih dari 8, kecuali untuk jumlah 18 dan 32.
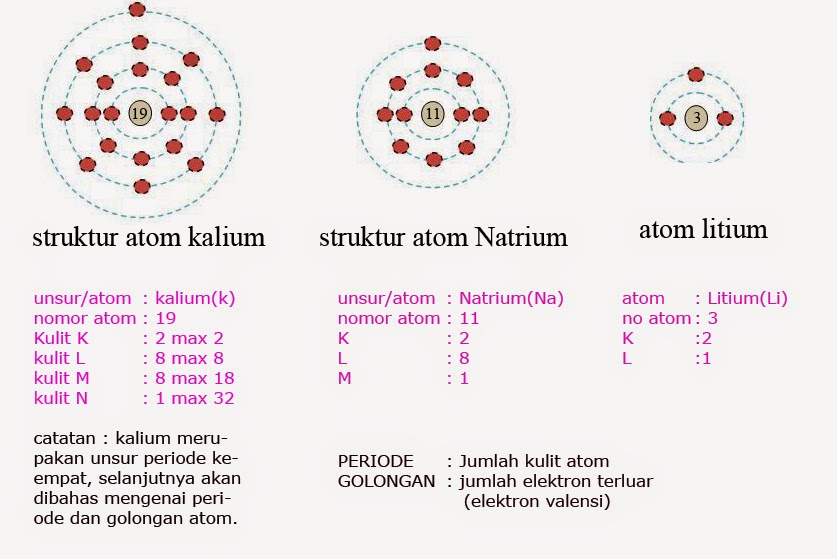
Contoh:
Kulit-kulit electron pada atom
Contoh:
Kulit-kulit electron pada atom
Banyaknya
electron pada kulit paling luar dan jumlah kulit electron menentukan sifat
unsure. Electron bergerak mengelilingi inti atom sambil berputar pada sumbunya,
seperti gerak planet-planet mengelilingi matahari. Gerakan tersebut disebut
gerak spin.
Electron-elektron
berputar pada sumbunya dan bergerak mengelilingi inti atom pada orbit
elektronnya. Makin jauh kedudukan electron terhadap inti atom, makin cepat
gerak berputarnya. Oleh karena itu, electron yang berada di kulit luar
mempunyai energy lebih besar daripada energy pada kulit yang lebih dalam. Jadi
energy electron pada kulit M lebih besar daripada energy electron pada kulit L
(EM > EL).
Akibat pengaruh
sesuatu, electron dapat berpindah dari kulit yang satu ke kulit didekatnya.
Perpindahan electron dari kulit dalam ke kulit luar desebut eksitasi.
Nomor Massa dan Nomor Atom
Massa atom suatu
unsure merupakan massa relative unsure itu dibandingkan massa sebuah atom
hydrogen. Banyaknya proton di dalam inti atom disebut nomor atom yang diberi
lambang Z. Pada atom netral, banyaknya proton dalam inti sama dengan banyaknya
electron sehingga nomor atom merupakan banyaknya electron yang beredar
mengelilingi inti atom. Banyaknya proton dan neutron di dalam inti atom disebut
nomor massa yang diberi lambang A. Jika lambang atom adalah X maka penulisan
sebuah atom menjadi:
p = proton, nilai p = e (elektron)
n = neutron
A - Z = n

 RSS Feed
RSS Feed Twitter
Twitter 09.55
09.55
 Unknown
Unknown




 Posted in
Posted in 


0 komentar:
Posting Komentar